Questa è una spiegazione semplificata di come funziona la classificazione degli embrioni e delle blastocisti nei trattamenti di PMA: come devono presentarsi al microscopio in base ai giorni trascorsi dalla fecondazione e quali caratteristiche dovrebbero avere per essere considerati di alta qualità.
Indice
- Come si ottengono gli embrioni in un trattamento di PMA?
- Come vengono classificati gli embrioni?
- Criteri di classificazione degli embrioni
- La sigla di classificazione delle blastocisti
- L’importanza dell’osservazione
- Embrione in prima giornata: gli ovociti sono stati fecondati?
- Embrione in seconda giornata
- Embrione in terza giornata
- Embrione in quarta giornata (morula)
- Embrione in quinta giornata (blastocisti)
- I sistemi time-lapse
- Fonti
Come si ottengono gli embrioni in un trattamento di PMA?
I percorsi di fecondazione assistita di secondo livello, come la FIVET e l’ICSI, prevedono diversi passaggi:
- la diagnosi del problema di infertilità,
- la scelta del trattamento farmacologico,
- la stimolazione ormonale,
- il prelievo ovocitario (pick-up),
- la fecondazione in vitro,
- la coltura degli embrioni e
- la scelta degli embrioni da trasferire e/o crioconservare (ossia congelare).
Quando gli ovociti arrivano in laboratorio dopo il pick-up, sono gli embriologi a prendersi cura di loro.
Gli ovociti prelevati vengono classificati e, se sono maturi, vengono fecondati in vitro o tramite ICSI: la scelta tra queste due metodiche dipende qualità dello spermiogramma del partner della donna.
Dopo la fecondazione, gli embrioni vengono tenuti all’interno di incubatori in appositi terreni di coltura e controllati giornalmente fino al transfer, che in genere si esegue in seconda o terza giornata (allo stadio di embrione) o in quinta giornata (allo stadio di blastocisti).
Come vengono classificati gli embrioni?
Il successo del transfer dipende dalla qualità degli embrioni, oltre che da quella dell’endometrio della donna e dalla sua ricettività.
Per valutare la qualità degli embrioni, si analizza la loro morfologia e il loro sviluppo nel tempo. Inoltre, attraverso la diagnosi preimpianto o PGT è possibile studiare anche il loro assetto cromosomico. La diagnosi preimpianto, tuttavia, non è un esame di routine e viene eseguito solo in presenza di determinate problematiche.
Nella pratica clinica, quindi, la classificazione degli embrioni si effettua in base alla loro morfologia e al loro sviluppo nel tempo.
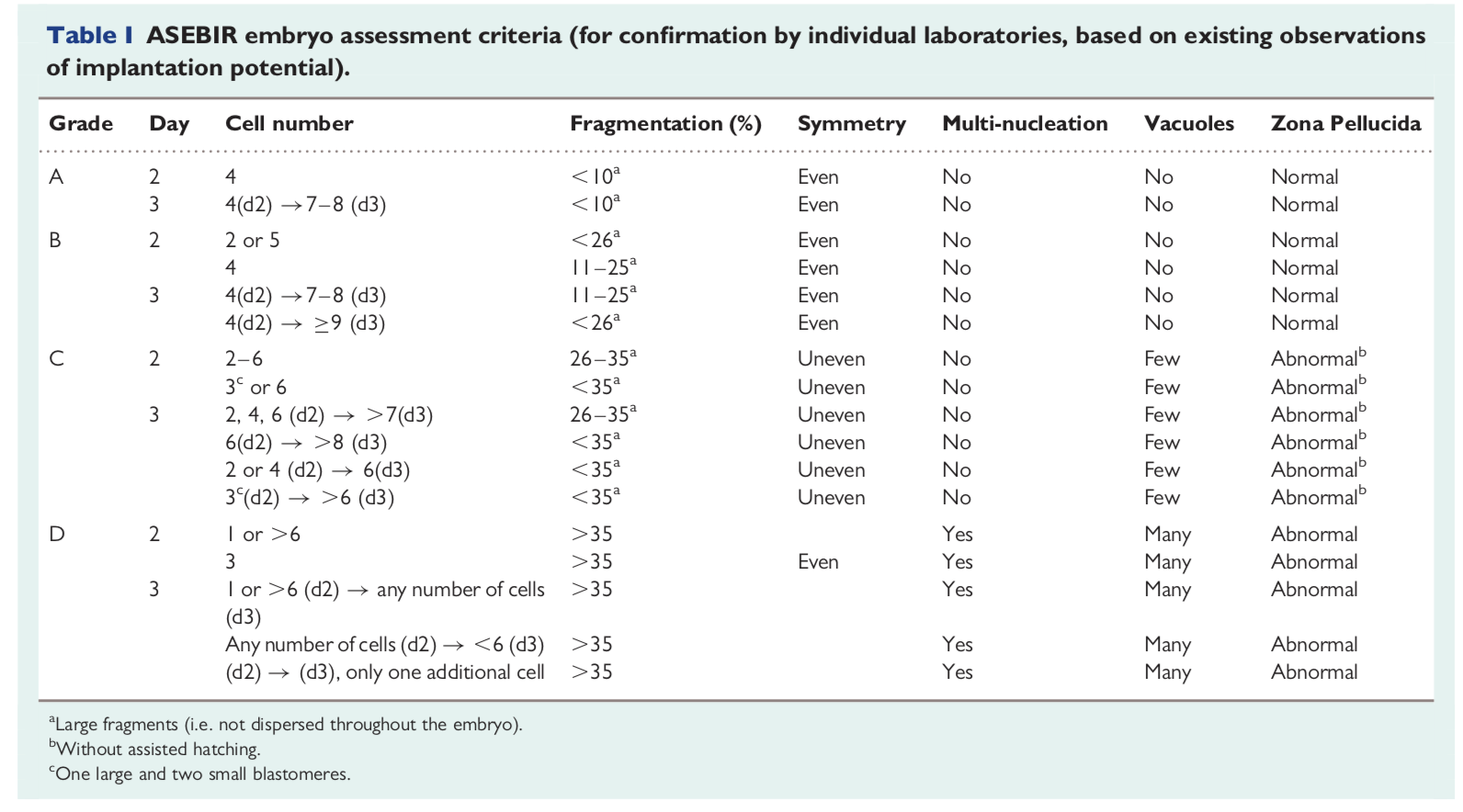
Criteri di classificazione degli embrioni
I principali criteri di classificazione degli embrioni e delle blastocisti usati nei laboratori di PMA sono ASEBIR e Gardner.
I criteri di classificazione ASEBIR
I criteri di ASEBIR vanno a valutare il numero ci cellule, il grado di frammentazione, la simmetria, il numero di nuclei, la presenza dei vacuoli e la morfologia della zona pellucida a seconda dei giorni trascorsi dall’inseminazione.
Questi parametri permettono di classificare gli embrioni in una delle seguenti categorie:
- Grado A = ottima qualità
- Grado B = buona qualità
- Grado C = scarsa qualità
- Grado D = transfer non raccomandato
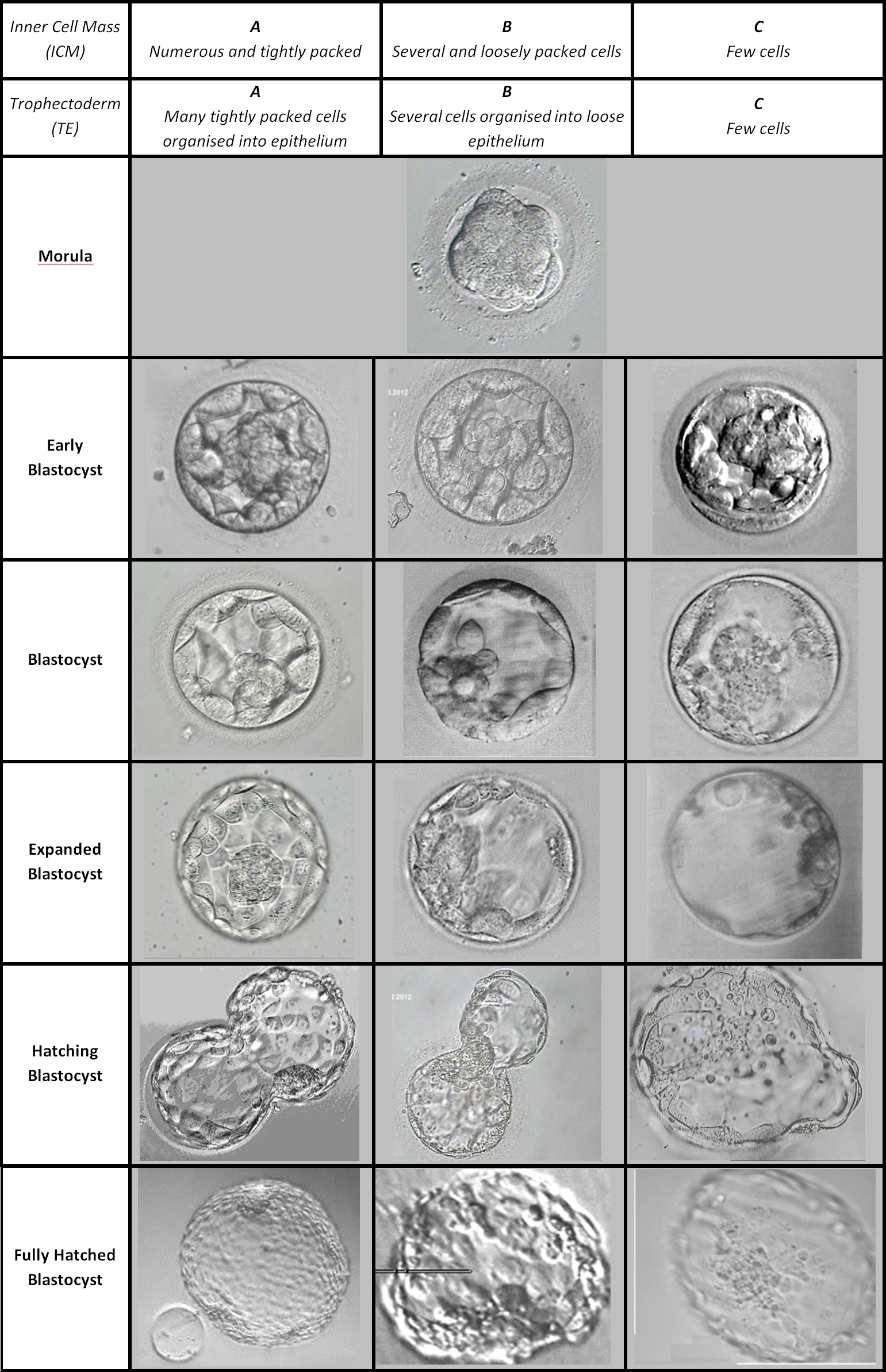
I criteri di Gardner
I criteri di Gardner sono riassunti nel diagramma sottostante.
Ad oggi, tuttavia, non è stato ancora chiaramente stabilito quale caratteristica morfologica delle blastocisti (grado di espansione, trofoblasto o massa cellulare interna) sia più affidabile come fattore predittivo per il successo dell’impianto post-transfer.
Di conseguenza, c’è ancora un dibattito tra autori sugli esiti reali del trasferimento singolo di blastocisti di bassa qualità (Bouillon et al. 2017).
La sigla di classificazione delle blastocisti
Attualmente, nella maggior parte dei centri di fecondazione assistita, le blastocisti vengono classificate con una sigla composta da un numero e due lettere (ad es. 3AB)
- Il numero rappresenta il grado di espansione dell’embrione, espresso con un valore da 3 a 6, dove 6 è il punteggio migliore.
- La prima lettera indica quante cellule formano il polo embrionario (o massa cellulare interna, che darà origine al feto). Il punteggio va da A a C, dove A è il punteggio migliore.
- La seconda lettera fa riferimento al trofoectoderma (che darà origine alla placenta) e ha un punteggio che va da A a C, dove A rappresenta il punteggio migliore.
La variabile più importante delle tre sembra essere il polo embrionario. Una blastocisti 4AA ha quindi ottime probabilità di portare a una gravidanza.
Una domanda che sorge spontanea è questa: che relazione c’è tra la classificazione morfologica e la probabilità di gravidanza?
Purtroppo non è possibile dare una risposta definitiva, anche perché i punteggi possono dare interpretazioni diverse (ad esempio, un 3AA è migliore di un 4AB?).
Tuttavia, la maggior parte degli studi che hanno provato a mettere in relazione punteggi e gravidanze sono giunti a due conclusioni principali:
- gli embrioni con i punteggi migliori hanno maggiori probabilità di portare a una nascita e a un “bimbo in braccio” rispetto a quelli con punteggi peggiori;
- la morfologia non è predittiva, ossia gli embrioni “belli” possono fallire e gli embrioni “meno belli” possono portare alla nascita di un bambino.
L’importanza dell’osservazione
Gli embriologi, una volta inseminati gli ovociti, valutano la qualità degli embrioni registrando le loro caratteristiche nel tempo.
Il successo del trattamento (e quindi l’instaurarsi della gravidanza) è strettamente legato alla morfologia degli embrioni e al loro sviluppo in vitro. Per aumentare al massimo le probabilità di successo della gravidanza è fondamentale la capacità di selezionare gli embrioni con il più alto potenziale di sviluppo.
Questa capacità si traduce in riduzione del “time to pregnancy” (ossia del tempo necessario per arrivare ad ottenere la gravidanza) e facilita anche la classificazione degli embrioni rimanenti che devono essere crioconservati, in modo da trasferire per primi gli embrioni più vitali. Gli embrioni ad alta vitalità, in base alla classificazione Gardner, solo quelli che hanno il più alto potenziale di impianto (ossia di attecchimento nell’utero).
La valutazione della morfologia è sempre stato il metodo principale per la selezione degli embrioni, ma non va disgiunta dalle tempistiche di osservazione. Questo perché un embrione osservato in seconda giornata alle 8 del mattino può avere caratteristiche completamente diverse se osservato allo stesso giorno ma ad esempio a mezzogiorno.
Per questo motivo la morfologia e l’intervallo di tempo trascorso dall’inseminazione devono andare “a braccetto”. Con l’avvento della microscopia time-lapse nei laboratori, è ora possibile catturare la morfologia in un continuum temporale e questo sta dando la possibilità di creare degli algoritmi per la selezione degli embrioni “migliori”.
Embrione in prima giornata: gli ovociti sono stati fecondati?
Il giorno dopo la fecondazione (circa 16-20 ore dopo l’inseminazione) gli embriologi controllano se gli ovociti sono stati fecondati e sono diventati zigoti.
Lo zigote è la prima cellula del bambino, formata dall’unione di ovulo e spermatozoo. Al suo interno, si dovrebbero trovare due pronuclei (della mamma e del papà) e due globuli polari.
Non tutti gli ovociti si fecondano, perché immaturi o perché troppo maturi, e quindi con una minore capacità di essere fecondati.
Se molti ovociti non sono stati inseminati, questo potrebbe indicare una scarsa qualità delle cellule uovo prelevate.
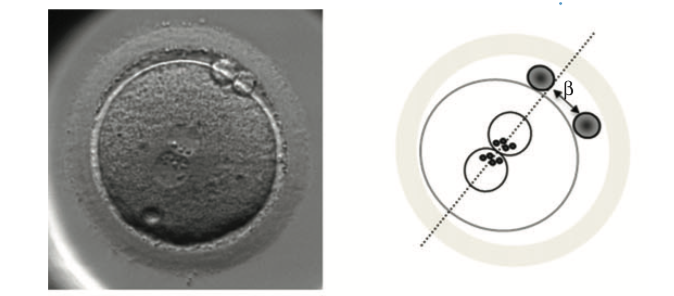
In questa foto, vedete uno zigote di ottima morfologia al giorno 1, con all’interno i due pronuclei e verso l’esterno i due globuli polari.
Gli embriologi valutano il numero dei precursori dei nucleoli all’interno dei pronuclei, la loro polarizzazione e la disposizione dei pronuclei rispetto ai globuli polari.
Embrione in seconda giornata
Alcuni centri di fecondazione assistita preferiscono non controllare gli embrioni in seconda giornata, ma farlo direttamente alla terza. Questo per evitare sollecitazioni ambientali e non esporre quindi gli embrioni alla luce e a cambiamenti di temperatura e pH.
Se si osservano in seconda giornata ci si aspetta che abbiano da 2 a 4 cellule (dette blastomeri).
Gli embrioni migliori hanno blastomeri di uguali dimensioni, ognuno con un singolo nucleo e con una percentuale di frammentazione (secondo Gardner) inferiore al 20%.

Che cos’è la frammentazione?
Si tratta dell’esito di una divisione irregolare/impura delle cellule dell’embrione.
Quando le cellule in un embrione si dividono, questo processo dovrebbe essere “pulito” e uniforme.
Pensate a un biscotto: quando lo dividete, se si formano briciole o frammenti, queste sono una sorta di impurità. Allo stesso modo le cellule, quando si dividono, possono formare dei frammenti.
Nell’embrione, questi frammenti sono solitamente esclusi, poiché non sono utili all’embrione e vengono classificati come “rifiuti”.
Maggiore è il grado di frammentazione, minore è la probabilità di gravidanza, in quanto questi frammenti esclusi potrebbero contenere materiale genetico vitale necessario per il normale sviluppo embrionale.
Embrione in terza giornata
Un embrione di ottima morfologia e vitalità in terza giornata dovrebbe avere almeno 7 blastomeri (mononucleati) di uguali dimensioni e una frammentazione inferiore al 20%.

Un embrione di ottima morfologia e vitalità in terza giornata dovrebbe avere almeno 7 blastomeri (mononucleati) di uguali dimensioni e una frammentazione inferiore al 20%.
Oltre alle cellule, al loro numero e alla loro morfologia, viene anche valutato lo spessore della zona pellucida, una sorta di “guscio” che circonda l’embrione. Questo perché, per potersi impiantare all’interno dell’utero, l’embrione deve riuscire a liberarsi di questo strato esterno (hatching).
In alcuni embrioni, la zona pellucida risulta ispessita, cosa che rende loro difficile “schiudersi” tra il giorno 5 e 6.
In questo caso, si può ricorrere all’Assisted Hatching: si esegue una piccola incisione a livello della zona pellucida, per favorire questo processo.
Se sono stati prelevati molti ovociti e si è ottenuta un’alta percentuale di inseminazioni, in genere si sceglie di procedere fino alla quinta giornata, per arrivare allo stadio di blastocisti.
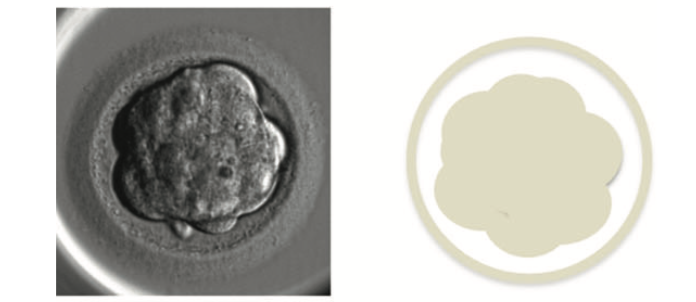
Embrione in quarta giornata (morula)
Come per il giorno 2, anche in questo stadio le osservazioni possono essere risparmiate, per evitare sollecitazioni ambientali, oltre al fatto che l’osservazione degli embrioni in questo giorno di solito non fornisce molte informazioni aggiuntive sulla qualità.
In questa fase, i blastomeri si avvicinano tra loro e si possono trovare in una formazione compatta (morula).
Le caratteristiche di una morula ad alta vitalità (sempre secondo Gardner) sono:
- cellule visibilmente compattate, con una leggera riduzione delle dimensioni complessive dell’embrione e l’aumento di spazio tra l’embrione e la zona pellucida;
- assenza di frammentazione.
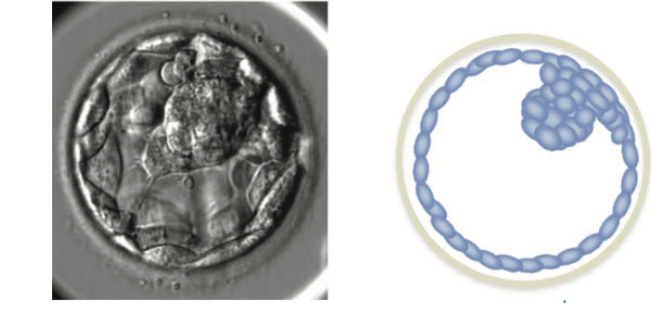
Embrione in quinta giornata (blastocisti)
La blastocisti ha delle caratteristiche ben definibili.
Si distinguono tre parti principali che devono essere valutate dagli embriologi:
- il blastocele (una cavità), che deve essere ben espansa al giorno 5;
- la massa cellulare interna o nodo embrionale, ben formata e composta da molte cellule;
- il trofoblasto, un epitelio coeso costituito da molte cellule;
- segnali di assottigliamento della zona pellucida.
Il potenziale di impianto di un embrione che è riuscito a svilupparsi fino alla quinta giornata è superiore a quello di un embrione in terza giornata. Inoltre, se si trasferiscono due embrioni in quinta giornata, aumenta del 20-25% anche la possibilità di gravidanza gemellare monozigote, col rischio dunque di favorire gravidanze plurigemellari. Questa è la ragione per cui oggi si trasferisce generalmente una sola blastocisti.
È bene precisare che la classificazione in base alla morfologia aiuta a valutare la vitalità degli embrioni e il successo della gravidanza, ma non è una verità assoluta.
I sistemi time-lapse
A partire dal 2009, sono apparsi sul mercato gli incubatori dotati di tecnologia Time-lapse (TLT). Si tratta di incubatori che permettono la coltura ininterrotta degli embrioni fino allo stadio di blastocisti all’interno di sistemi che non richiedono la manipolazione quotidiana, grazie all’utilizzo di appositi terreni di coltura, riducendo quindi lo stress degli embrioni.
Inoltre, registrano le divisioni cellulari e lo sviluppo morfologico scattando fotografie ad intervalli di 5-15 minuti, permettendo quindi la valutazione dinamica degli embrioni (Lundin, 2020).
Dal punto di vista scientifico, questa tecnologia ha consentito di identificare aspetti dello sviluppo embrionale precedentemente sconosciuti o non identificabili mediante l’osservazione tradizionale.
Dal punto di vista clinico, gli incubatori TLT hanno reso possibile lo sviluppo di algoritmi per selezionare gli embrioni, ma che necessitano di ulteriori studi scientifici per la loro validazione.
Sicuramente, ad oggi, rappresentano un sistema grazie al quale si possono ottenere condizioni di coltura ottimizzate e stabili insieme alla continua documentazione dello sviluppo embrionale. Le prospettive future fanno pensare che, utilizzando gli incubatori TLT in abbinamento a programmi di Intelligenza Artificiale (AI), si possa arrivare a stabilire precisi criteri di identificazione degli embrioni dotati delle migliori capacità di impianto (ESHRE working group, 2020).
Aggiornamento a cura di:
Dott. Ruggero Comi, specialista in Ginecologia e Ostetricia del Centro di Medicina della Riproduzione Biogenesi degli Istituti Clinici Zucchi di Monza.
Fonti
Grupo de Interés de Embriología. CUADERNOS DE EMBRIOLOGÍA CLÍNICA. Criterios ASEBIR de Valoración Morfológica de Oocitos, Embriones Tempranos y Blastocistos Humanos.(3ª Edición · 2015) Madrid: Góbalo, Agencia Creativa Digital.
D.K. Gardner; A. Weissman; C.M. Howels; Z. Shoham. Textbook of Assisted ReproductiveTechinques. 2012 London: Informa-Healthcare.
D.K. Gardner and Basak Balaban. Assesment of human embryo development using morphological criteria in an era of time-lapse, algorithms and ‘OMICS’: is lookin good still important? Molecular Human Reproduction Vol.22 No.10 pp704-718 2016
B. Wirleitner, M. Schuff, A. Stecher, M. Murtinger, and P. Vanderzwalmen. Pregnancy and birth outcomes following fresh or vitrified embryo transfer according to blastocyst morphology and expansion stage, and culturing strategyfor delayed development. Human Reproduction Vol 31 No. 8 pp1685-1695, 2016
Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Human Reproduction, Vol.26, No.6 pp. 1270–1283, 2011
M. Cristina Magli Gayle M. Jones Kersti Lundin Etienne Van den Abbeel . ATLAS OF HUMAN EMBRYOLOGY From Oocytes To Preimplantation Embryos. An ESHRE SIG Embryology Initiative
Bouillon C, Celton N, Kassem S, Frapsauce C, Guérif F. Obstetric and perinatal outcomes of singletons after single blastocyst transfer: is there any difference according to blastocyst morphology? Reprod Biomed Online 2017;35:197–207